Ионы, находящиеся во внешней сфере комплексных соединений, связаны с комплексным ионом в основном силами электростатического взаимодействия. Комплексное соединение при электролитической диссоциации образуют комплексные ионы и ионы внешней сферы как сильные электролиты, например:
Комплексные соединения могут быть неэлектролитами. Например, [PtCl2(NH3)2] – неэлектролит, так как содержит только внутреннюю сферу.
Комплексные ионы подвергаются диссоциации как слабые электролиты. Упрощенно диссоциацию внутренней сферы можно представить таким образом:
Применяя закон действующих масс к обратимым процессам диссоциации комплексных ионов, получим выражения константы нестойкости комплексов:
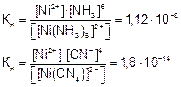
Константа нестойкости комплексного иона характеризует прочность (устойчивость) внутренней сферы комплексного иона. Чем меньше константа нестойкости, тем прочнее комплексный ион.
Комплекс [Ni(CN)4] 2– прочнее, чем [Ni(NH3)6] 2+ , так как
1,8•10 –14 –8 .
К комплексным соединениям близко примыкают двойные соли, т.е. соединения с малоустойчивой внутренней сферой. Например, KAl(SO4)2.
Двойные соли в отличие от комплексных соединений диссоциируют на все составляющие их ионы:
Пример. Напишите молекулярные и ионно-молекулярные уравнения получения комплексных соединений, полученных при взаимодействии раствора ZnSO4 с избытком растворов NH4OH и NaCN.
Решение.Определяем комплексообразователь и его степень окисления: Zn 2+ .
Координационное число Zn 2+ равно четырем.
Составляем внутреннюю координационную сферу и определяем ее заряд, который равен алгебраической сумме зарядов, образующих его простых ионов (нейтральные молекулы NH3 не влияют на заряд). Внутреннюю сферу заключаем в квадратные скобки:
[Zn(CN)4] 2– — комплексный анион.
Определяем ионы внешней координационной сферы:
Составляем формулы комплексных соединений:
Молекулярное уравнение получения [Zn(NH3)4]SO4:
Молекулярное уравнение получения Na2[Zn(CN)4]:
Пример. Определите заряд комплексного иона, координационное число и степень окисления комплексообразователя в соединениях:
Решение.Заряд комплексного иона равен заряду внешней сферы, но противоположен ему по знаку. Координационное число равно числу лигандов, координированных вокруг комплексообразователя. Степень окисления комплексообразователя определяется из того, что алгебраическая сумма степеней окисления всех атомов и молекул в соединении равна нулю. Заряды нейтральных молекул равны нулю.
| Комплексное соединение | Заряд комплексного иона | Координационное число | Степень окисления комплексообразователя |
| K2[Sn(OH)4] [Cr(H2O)4Cl2]Cl | [Sn(OH)4] 2– [Cr(H2O)4Cl2] + | Sn +2 Cr +3 |
8. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ СВОЙСТВА
ВЕЩЕСТВ
Окислительно-восстановительные реакции – это реакции, сопровождающиеся изменением степени окисления атомов в молекулах реагирующих веществ в результате перехода электронов от одних атомов к другим.
Под степенью окисления понимают условный заряд атома в соединении, вычисленный, исходя из предположения, что соединение состоит из ионов. Степень окисления атомов определяют, пользуясь следующими правилами:
1. Степень окисления в простом веществе (например, O2, N2, Cl2, Zn, S и др.) равна нулю
2. Степень окисления кислорода в соединениях равна -2, за исключением пероксидов (например, Н2О2 –1 ) и и фторида кислорода O +2 F2.
3. Степень окисления водорода в соединениях равна +1, за исключением гидридов (например, NaH –1 , CaH2 –1 ).
4. Степень окисления фтора в соединениях равна -1.
5. Алгебраическая сумма степеней окисления всех атомов в молекуле равна нулю, а в сложном ионе – заряду иона.
Руководствуясь этими правилами, можно рассчитать степень окисления любого атома. Например,
HNO3 Степень окисления азота х=+5
Характерные степени окисления атомов элементов главных и побочных подгрупп периодической системы приведены в табл.1 и 2.
Характерные степени окисления атомов элементов
главных подгрупп
| Степень окисления | Номер группы | ||||||
| I | II | III | IV | V | VI | VII | |
| Положительная Отрицательная | +1 | +2 | +3 | +4 +2 -4 | +5 +3 -3 | +6 +4 -2 | +7 +5 +3 +1 -1 |
Характерные степени окисления атомов элементов
побочных подгрупп
| Номер подгруппы | |||||||
| I | II | III | IV | V | VI | VII | VIII |
| Cu +2 Cu +1 Ag +1 Au +3 Au +1 | Zn +2 Cd +2 Hg +2_ Hg +1 | +3 | +4 | +5 | Cr +6 Cr +3 Cr +2 (неуст.) | Mn + 7 Mn +6 Mn +4 Mn +2 | Fe +3 Fe +2 Fe +6 (неуст.) Co +3 Co +2 Ni +3 Ni +2 |
В окислительно-восстановительных реакциях одновременно протекают два процесса: окисление и восстановление.
Окисление – это процесс отдачи электронов, приводящий к повышению степени окисления атома.
Восстановление – это процесс присоединения электронов, приводящий к понижению степени окисления атома.
Вещество, которое отдает электроны, называется восстановителем, а вещество, принимающее электроны — окислителем.
К типичным окислителям относятся:
— металлы и неметаллы в высшей степени окисления: Cr +6 , Mn +7 , Sn +4 , Fe +3 , N +5 , S +6 , Cl +7 и др.
К типичным восстановителям относятся:
— металлы: Mg, Al, Zn и др.;
— металлы и неметаллы в низшей степени окисления: Fe +2 , Sn +2 , Mn +2 , S –2 , Cl –1 , J –1 и др.
Вещества, в состав которых входит элемент в промежуточной степени окисления, проявляют окислительно-восстановительную двойственность: по отношению к окислителям они являются восстановителями, а по отношению к восстановителям – окислителями. Например, 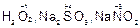 и др.
и др.
Процессы перехода электронов в окислительно-восстановительных реакциях выражаются электронными уравнениями. При этом должно выполняться условие электронного баланса: число электронов, принятых окислителем, равно числу электронов, отданных восстановителем.
Порядок составления уравнений
окислительно-восстановительных реакций
1. Записать в левую часть уравнения формулы исходных веществ.
2. Пользуясь табл.1 и 2, определить атомы, которые способны изменять степень окисления.
3. Определить среди исходных веществ:
— среду (кислая среда – H2SO4, HCl, HNO3; щелочная среда – NaOH, KOH, NH4OH; нейтральная среда – Н2О);
4. Определить новые степени окисления атомов, пользуясь табл.1 и 2:
— изменение степени окисления происходит обычно до ближайшей или наиболее устойчивой степени окисления;
— атомы в отрицательной степени окисления обычно повышают ее до нулевой.
Например: S –2 — 2 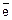 ® S 0
® S 0
2J –1 — 2 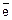 ® J2 0
® J2 0
— атомы марганца изменяют степень окисления в зависимости от среды: в кислой среде – до +2 или +7, в щелочной – до +6, в нейтральной – до +4;
— если в реакции меняют степень окисления атомы одного и того же элемента, находящиеся в двух разных степенях окисления, то в ходе реакции они перейдут в одинаковую (промежуточную) степень окисления.

 Например: S +4 Mn +2
Например: S +4 Mn +2

 S 0 Mn +4
S 0 Mn +4
5. Составить электронные уравнения, учитывая внутримолекулярные индексы. Например: если атомы хрома из K2Cr2O7 меняют степень окисления с +6 до +3, то следует учесть индекс 2 и составить электронное уравнение для двух атомов хрома:
2Cr +6 + 6 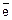 ® 2Cr +3
® 2Cr +3
6. Справа от электронных уравнений провести вертикальную черту и цифры, стоящие перед электронами, перенести накрест, сокращая, если можно. Это основные коэффициенты реакции.
7. Вывести формулы продуктов реакции.
Если новая степень окисления атома элемента положительная, то для вывода формулы продукта необходимо составить следующую цепочку:
Э +n ® оксид ® гидроксид ® соль
(металл (характер (кислота или
или неметалл) оксида) основание)
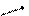 Al(OH)3 основание
Al(OH)3 основание
 Al +3 ® Al2O3 ®
Al +3 ® Al2O3 ®
металл амфотерный HAlO2 кислота
Формула соли будет определяться средой:
в кислой среде 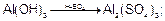
в щелочной среде 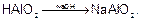
Если новая степень окисления атома элемента отрицательная, то для вывода формулы продукта необходимо составить следующую цепочку:
Э – n ® водородное соединение ® соль
Для вывода формул остальных продуктов реакции следует объединить оставшиеся ионы исходных веществ друг с другом или ионами среды.
8. Поставить основные коэффициенты в уравнение реакции перед формулами окислителя, восстановителя и их продуктами.
9. Расставить коэффициенты перед формулами остальных участников реакции так, чтобы выполнялось условие материального баланса: число атомов каждого элемента в левой и правой частях уравнения должно быть одинаковым.
10. Убедиться в правильности подбора коэффициентов уравнения: число атомов кислорода в левой и правой частях уравнения должно быть одинаковым.
Пример 1. Составить уравнение реакции
Решение. Элементами, меняющими степень окисления в этой реакции, являются хром и азот. Реакция протекает в кислой среде (H2SO4). Атомы хрома Cr +6 понижают свою степень окисления до Cr +3 , поэтому K2Cr2O7 является окислителем. Атомы азота N +3 повышают степень окисления до N +5 , поэтому NaNO2 – восстановитель.
Составим электронные уравнения:

 2Cr +6 + 6
2Cr +6 + 6 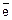 ® 2Cr +3 2 1
® 2Cr +3 2 1
N + — 2 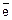 ® N +5 6 3
® N +5 6 3
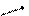 Cr(OH)3 ® Cr2(SO4)3
Cr(OH)3 ® Cr2(SO4)3

 Сr +3 ® Cr2O3 ®
Сr +3 ® Cr2O3 ®
металл амфотерный HCrO2
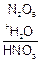 Na +
Na +
Если атом элемента N + , входящий в состав кислотного остатка (NO2 – ), изменив степень окисления, оказался в составе нового кислотного остатка (NO3 – ), то в формуле продукта сохранится катион (Na + ).
Запишем уравнение со всеми продуктами:
Расставим основные коэффициенты перед окислителем K2Cr2O7 и его продуктом Cr2(SO4)3 – 1, перед восстановителем NaNO2 и его продуктом NaNO3 – 3.
Расставим коэффициенты перед формулами остальных веществ:
Проверка: 29 «О»=29 «О».
Пример 2. Составить уравнение реакции
Решение. Элементами, меняющими степень окисления, являются висмут и хлор. Реакция протекает в щелочной среде (NaOH). Висмут находится в пятой группе периодической таблицы в главной подгруппе: характерными степенями окисления являются +3 и +5. В этой реакции висмут – восстановитель и повышает степень окисления от +3 до +5. Хлор – окислитель и понижает степень окисления от 0 до –1.
Составим электронные уравнения:

 Bi +3 — 2
Bi +3 — 2 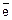 ® Bi +5 2 1
® Bi +5 2 1
Cl2 0 + 2 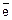 ® 2Cl – 2 1
® 2Cl – 2 1
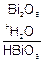
 NaOH
NaOH
Задача 729.
Установить, в каких случаях произойдет взаимодействие между растворами указанных электролитов. Написать уравнения реакций в молекулярной и ионно-молекулярной форме:
а) К 2 [HgI 4 ] + KBr;
б) К 2 [HgI 4 ] + KCN;
в) [Ag(NH3)2]Cl + K2S2O3;
г) K[Ag(CN)2] + KBr;
д) K[Ag(CN)2] + NH3;
е) K[Ag(NO2)2] + NH3;
ж) [Ag(NH3)2]Cl + NiCl2;
з) K3[Cu(CN)4] + Hg(NO3)2.
Решение:
а) К 2 [HgI 4 ] + KBr;
Реакция не протекает так как Kн(K2[HgI4] 2- ) 2- ),
При диссоциации К2[HgI4] и KBr образуются ионы К +, Br — и [HgI4] 2- , который обладает большой устойчивостью:
2K + + [HgI4] 2- + K + + Br — = 3K + + [HgI4] 2- + Br — — реакция не протекает.
б) К2[HgI4] + KCN;
Реакция протекает так как Kн(K2[HgI4]) > Kн(K2[Hg(CN)4], получим:
K2[HgI4] + 4KCN = K2[Hg(CN)4] + 4KI (молекулярная форма);
2K + + [HgI4] 2- + 4K + + 4CN — = 2K + + [Hg(CN)4] 2- + 4K + + 4I — (полная ионная форма);
[HgI4] 2- + 4CN — = [Hg(CN)4] 2- + 4I — (сокращенная ионная форма).
г) K[Ag(CN)2] + KBr;
Реакция не протекает так как при диссоциации K[Ag(CN)2] и KBr образуются ионы К+, Br- и [Ag(CN)2] -, который обладает большой устойчивостью.
д) K[Ag(CN)2] + NH3
Реакция не протекает так как Kн([Ag(CN)2] — ) + ). При диссоциации K[Ag(CN) 2 ] образуются ионы К + и [Ag(CN)2] — , который ведет себя в обменных реакциях как неразрывное целое:
K[Ag(CN) 2 ] + NH3 = K + + [Ag(CN)2] — + NH3.
е) K[Ag(NO2)2] + NH3
При диссоциации K[Ag(NO 2 ) 2 ] образуются ионы K + и [Ag(NO 2 ) 2 ] — , который обладает большой устойчивостью:
K[Ag(NO2)2] = K + и [Ag(NO 2 ) 2 ] — . Реакция не протекает, так как ион [Ag(NH3)2] + не образуется, потому что K н ([Ag(NO 2 ) 2 ] — ) 3 ) 2 ] + .
ж) [Ag(NH3)2]Cl + NiCl2;
Как электролиты обе соли диссоциируют:
[Ag(NH3)2]Cl = [Ag(NH3)2] + + Сl — ;
NiCl2 = N1 2+ + 2Cl — .
Ионы Ag + и Cl — соединяясь друг с другом образуют нерастворимое соединение AgCl, а ион Ni2+ с NH3 образует комплекс [Ni(NH3)6]2+, так как Kн (Ni(NH3)6] 2+ ) K н ([Ag(NH 3 ) 2 ] + ), получим:
3[Ag(NH3)2]Cl + NiCl2 = [Ni(NH3)6]Сl2 + 3AgCl↓ (молекулярная форма);
3[Ag(NH3)2] + + Cl — + Ni 2+ + 2Cl — = [Ni(NH3)6] 2+ + 2Сl — + 3AgCl↓ (полная ионная форма);
3[Ag(NH3)2] + + Ni 2+ + 3Cl — = [Ni(NH3)6] 2+ + 3AgCl↓ (сокращенная ионная форма).
Задача 730.
Вычислить концентрацию ионов Ag+ в 0,1 М растворе [Ag(NH3)2]NO3, содержащем в избытке 1 моль/л NH3.
Решение:
Константа нестойкости иона [Ag(NH3)2] + равна 9,3 . 10 -8 . Вторичная диссоциация комплексного иона протекает по схеме:
[Ag(NH3)2]+ = Ag + + 2NH3
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда [NH3] = С(NH3 ) = 1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2] + может быть приравнена общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
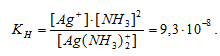
Отсюда выражаем концентрацию ионов Ag+:
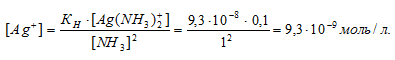
Ответ: 9,3 . 10-8 моль/л.
Задача 731.
Вычислить концентрацию ионов кадмия в 0,1 М растворе K2[Cd(CN)4], содержащем, кроме того, 6,5 г/л КCN.
Решение:
M(KCN) = 65г/моль. Рассчитаем концентрацию цианида калия:
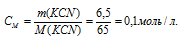
Константа нестойкости иона [Cd(CN)4] 2+ равна 7,8 . 10 -18 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка ионов CN — , создаваемого в результате диссоциации КCN (которую можно считать полной), это равновесие смещено влево настолько, что количество ионов CN — , образующихся при вторичной диссоциации, можно пренебречь. Тогда [Сd 2+ ] = С(соли) = 0,01 моль/л. По той же причине равновесная концентрация ионов [Cd(CN)4] 2- может быть приравнена к общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
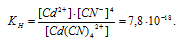
Отсюда выражаем концентрацию ионов Сd2+:
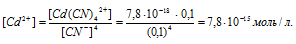
Ответ: 7,8 . 10-15 моль/л.
Задача 732.
Найти массу серебра, находящегося в виде ионов в 0,5 л 0,1 М раствора дитиосульфатоаргентата натрия Na3[Ag(S2O3)2], содержащем, кроме того, 0,1 моль/л тиосульфата натрия.
Решение:
М(Ag) = 107,868г/моль. Константа нестойкости иона [Ag(S2O3)2] 3- равна 1,1 . 10 -13 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка ионов S 2 O 3 2- , создаваемого в результате диссоциации К2S2O3 (которую можно считать полной), это равновесие смещено влево настолько, что количество ионов S 2 O 3 2- , образующихся при вторичной диссоциации, можно пренебречь. Тогда [Ag + ] = С(К2S2O3) = 0,1 моль/л. По той же причине равновесная концентрация ионов [Ag(S2O3)2] 3- может быть приравнена к общей концентрации комплексной соли (0,1 моль/л).По условию задачи:
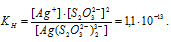
Отсюда выражаем концентрацию ионов Ag + :
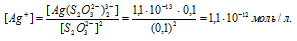
Теперь рассчитаем массу серебра, находящуюся в виде ионов в количестве 1,1 . 10 -12 моль/л в растворе комплексной соли:
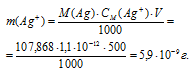
Ответ: 5,9 . 10 -9 г.
Задача 733.
Выпадет ли осадок галогенида серебра при прибавлении к 1 л 0,1 м раствора [Ag(NH3)2]NO3, содержащему 1 моль/л аммиака: а) 1 . 10 -5 моль КВг; б) 1 . 10 -5 моль КI? ПР(AgBr) = 6 . 10 -13 ; ПР(AgI) = 1,1 . 10 -16 .
Решение:
Константа нестойкости иона [Ag(NH3)2] + равна 9,3 . 10 -9 . Вторичная диссоциация комплексного иона протекает по схеме:
В присутствии избытка NH3, создаваемого в результате прибавления раствора аммиака, это равновесие смещено влево настолько, что количество NH3, образующегося при вторичной диссоциации, можно пренебречь. Тогда 3] = С(NH3 ) = 1 моль/л. По той же причине равновесная концентрация ионов [Ag(NH3)2] + может быть приравнена общей концентрации комплексной соли (0,1 моль/л).
По условию задачи:
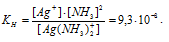
Отсюда выражаем концентрацию ионов Ag+:
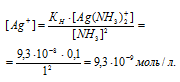
а) Уравнение реакции имеет вид:
Из уравнения реакции следует, что из 1 моль КBr и 1 моль [Ag(NH 3 ) 2 ]NO 3 образуется 1 моль AgBr. Так как [Ag + ] = 9,3 . 10 -9 моль/л ; [Br — ] =1 . 10 -5 моль/л, то произведение концентраций ионов Ag + и Br — будет равна: ( 9,3 . 10 -9 ) . ( 1 . 10 -5 ) = 9,3 . 10 -14 . Так как 9,3 . 10 -14 > 1 ,1 . 10 -16 , то осадок бромида серебра не образуется.

[Zn(NH3)4]SO4= SO4(2-) +[Zn(NH3)4](2+)
K2[Hg(CN)4]= 2K(+) + [Hg(CN)4]( -)
[Co(NH3)6]Cl2= [Co(NH3)6] (2+) +2Cl(-)
«>
