Содержание
Эквивалентом Э(Х)называется некая реальная или условная частица (атом, молекула, ион, радикал и т.п.), которая может присоединять, замещать или быть каким-либо другим образом эквивалентна одному моль атомов или ионов водорода в химических реакциях. В общем случае эквивалент элемента или вещества Х можно найти по формуле
Э(Х) = 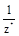 ,
,
где z * — число эквивалентности, равное тому количеству атомов или ионов водорода, которое эквивалентно (равноценно) частице Х.
Масса 1 моль эквивалента вещества или элемента Х называется молярной массой эквивалента МЭ(Х)(г/моль). Она связана с молярной массой частицы Х соотношением
МЭ(Х) = М(Х)× Э(Х) = 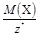 .
.
Значение числа эквивалентности z * элемента в каком-либо веществе равно модулю степени окисления (С.О.), проявляемой данным элементом в химическом соединении. Таким образом, расчет молярной массы эквивалента элемента следует вести по формуле
МЭ(Х) = 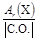 .
.
Для веществ, не участвующих в данный момент в какой-либо химической реакции, число эквивалентности равно:
1) для оксидов – произведению числа атомов элемента N на его валентность В, проявляемую в данном оксиде;
2) для кислот – ее основности, то есть числу атомов водорода, способных замещаться на катионы металлов;
3) для оснований – его кислотности, то есть количеству ионов ОН — , замещаемых на кислотные остатки при реакциях с кислотами;
4) для солей (средних) – произведению числа катионов NKt на элементарный заряд катиона ZKt.
Таким образом, расчет молярной массы эквивалента вещества не участвующего в химической реакции следует вести по одной из формул:
МЭ(оксида) = 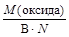 , МЭ(соли) =
, МЭ(соли) = 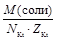 ,
,
МЭ(кислоты) = 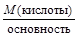 , МЭ(основания) =
, МЭ(основания) = 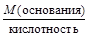 .
.
Если вещество участвует в реакции ионного обмена, то z * принимают равным числу ионов Н + или числу ионов ОН — , перешедших от одного вещества к другому, а молярная масса эквивалента рассчитывается по уравнению:
МЭ = 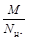 =
= 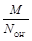 .
.
При расчете молярной массы эквивалента вещества, выполняющего роль окислителя (восстановителя) в окислительно-восстановительной реакции, число эквивалентности принимают равным количеству принятых (отданных) электронов Ne:
МЭ = 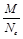 .
.
При решении некоторых задач, содержащих сведения об объемах газообразных участников реакции, целесообразно пользоваться не молярной эквивалентной массой, а молярным эквивалентным объемом вещества VЭ, то есть объемом, который при данных физических условиях занимает 1 моль эквивалентов газа. Расчет VЭ газа при нормальных условиях следует вести по формуле
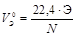 , дм 3 /моль,
, дм 3 /моль,
где Э – эквивалент элемента, составляющего газ; N – число атомов элемента в молекуле газа; 22,4 – молярный объем при н.у.
Достаточно часто уравнения химических реакций записывают в сокращенно-ионной форме, поэтому может возникнуть потребность в расчете молярной эквивалентной массы не молекулы, а иона. Для ионов МЭ вычисляют по формуле
МЭ(иона) = 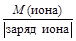 .
.
Пример 1. Вычислите молярную эквивалентную массу углерода в соединении CS2.
Определяем степени окисления элементов в сероуглероде 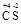 2. Тогда
2. Тогда
МЭ(С) = 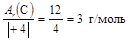 .
.
Пример 2.Определите молярные эквивалентные массы следующих соединений: Н3РО3, Са(ОН)2, Na2CO3.
1. Основность фосфористой кислоты равна двум, тогда
МЭ(Н3РО3) = 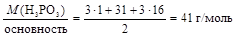 .
.
2. Кислотность гидроксида калия равна двум, следовательно
МЭ(Са(ОН)2) = 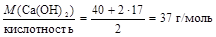 .
.
3. Число катионов в карбонате натрия равно двум, а заряд катиона равен +1, значит
МЭ(Na2CO3) = 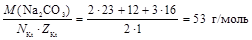 .
.
Пример 3.Вычислите молярные эквивалентные массы гидроксидов висмута и марганца, участвующих в реакциях
1. Реакция Bi(OH)3 + 2HNO3 = Bi(OH)(NO3)2 + 2H2O является ионно-обменным процессом, так как протекает без изменения степеней окисления элементов. В данном случае 1 моль гидроксида висмута обменивается с молекулами азотной кислоты двумя ионами ОН — , поэтому
МЭ(Bi(OH)3) = 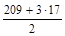 = 130 г/моль.
= 130 г/моль.
2. Реакция Mn(OH)2 + Cl2 + KOH ® MnO2 + KCl + H2O является окислительно-восстановительным процессом. С.О. атома марганца в гидроксиде равна +2, а в продукте реакции она составляет +4. Таким образом, атом марганца теряет два электрона в процессе окисления, тогда
МЭ(Mn(OH)2) = 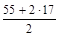 = 44,5 г/моль.
= 44,5 г/моль.
Пример 4. Вычислите молярный эквивалентный объем кислорода и водорода при н.у.
1. Газ Н2 состоит из двух атомов водорода. Эквивалент каждого атома Н равен 1, тогда
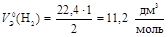 ;
;
2. Газ О2 содержит 2 атома кислорода. Чаще всего С.О. кислорода в сложном веществе равна –2, следовательно, эквивалент О равен 0,5. Тогда
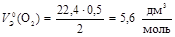 .
.
З А Д А Ч И
1. В какой массе гидроксида натрия содержится столько же эквивалентов, сколько в 140 г гидроксида калия?
2. Выразите в молях 3,01×10 23 молекул аммиака. Определите молярную эквивалентную массу данного соединения.
3. Определите эквивалент и молярную массу эквивалента фосфора, кислорода и брома в соединениях фосфид водорода, вода, бромоводород.
4. Запишите реакцию образования гидрофосфата калия при взаимодействии ортофосфорной кислоты с гидроксидом калия. Вычислите молярную массу эквивалента кислоты в данной реакции.
5. Напишите уравнение реакции гидроксида железа (III) с соляной кислотой, при которой образуется хлорид дигидроксожелеза. Вычислите молярную массу эквивалента гидроксида в данной реакции.
6. Определите молярную эквивалентную массу серной кислоты и гидроксида меди (II) в реакциях:
7. Избытком КОН подействовали на раствор дигидрофосфата калия. Запишите уравнение реакции и определите молярную массу эквивалента исходной соли.
8. Вычислите молярные массы эквивалентов окислителя и восстановителя в окислительно-восстановительной реакции:
9. Вычислите молярную эквивалентную массу гидроксохлорида кадмия в реакции с хлороводородом.
10. Вычислите эквивалент и эквивалентную массу H3PO4 при взаимодействии с гидроксидом калия с образованием: а) гидрофосфата; б) дигидрофосфата.
11. Напишите уравнение реакций Ni(OH)3 с хлороводородной кислотой, при которых образуются следующие соединения никеля: а) дигидроксохлорид; б) гидроксохлорид; в) трихлорид. Вычислите эквивалент и эквивалентную массу Ni(OH)3 в каждой из этих реакций.
12. Определите эквивалент и эквивалентную массу металла в следующих соединениях: Mn2O7, Mg2P2O7, Ca3(PO4)2, Ba(OH)2. Вычислите молярные эквивалентные массы каждого вещества.
14. Вычислите эквивалент и эквивалентную массу серной кислоты при взаимодействии с гидроксидом калия с образованием а) гидросульфата калия; б) сульфата калия.
15. Вычислите эквивалент и эквивалентную массу гидроксида кальция при взаимодействии с хлороводородной кислотой с образованием а) гидроксохлорида кальция; б) хлорида кальция.
16. Вычислите эквивалент и эквивалентную массу оксида магния и алюминия в следующих реакциях:
18. Вычислите эквивалентную массу следующих соединений: CuO, (NH4)2S, Ca(HCO3)2, AI(OH)2Cl.
20. Определите эквивалент и эквивалентную массу фосфора в следующих соединениях: РН3, Р2О5, Р2S3, КН2РО2.
21. Определите эквивалент и эквивалентную массу азота в следующих соединениях: а) аммиак; б) нитрат калия; в) нитрит калия; г) нитрид калия.
22. Определите эквивалент хлора и кислорода в следующих оксидах: Cl2О, Cl2О3, Cl2О5, Cl2О7. Эквивалент какого элемента остается постоянным и почему?
23. Сера образует три оксида, определите эквивалент серы и кислорода в этих оксидах. Эквивалент, какого элемента остается постоянным и почему?
24. Хром образует три оксида, определите эквивалент хрома и кислорода в этих оксидах. Эквивалент, какого элемента остается постоянным и почему?
25. Определите эквивалент и эквивалентную массу следующих кислот:
а) ортофосфорная; б) фосфорноватая.
26. Определите эквивалент и эквивалентную массу следующих кислот:
а) метафосфорная; б) фосфорноватистая.
27. Определите эквивалент и эквивалентную массу азота и серы в полуреакциях:
28. Определите эквивалент и эквивалентную массу азота и серы в полуреакциях:
29. Определите эквивалент и эквивалентную массу марганца в полуреакциях:
30. Определите эквивалент и эквивалентную массу хрома в полуреакциях:
ЗАКОН ЭКВИВАЛЕНТОВ
| | | следующая лекция ==> | |
| ЗАКОНЫ ГАЗОВОГО СОСТОЯНИЯ | | | Вычислим МЭ(О), зная что степень окисления кислорода в оксиде равна –2 |
Дата добавления: 2018-11-25 ; просмотров: 1911 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Количественный подход к изучению химических явлений и установление закона постоянства состава показали, что вещества вступают во взаимодействие в определенных соотношениях масс, что привело к введению такого важного понятия, как «эквивалент», и установлению закона эквивалентов: массы взаимодействующих без остатка веществ соотносятся как их эквивалентные массы.
Математическое выражение закона эквивалентов:
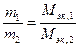 ,
,
Эквивалент — это частица или часть частицы, которая соединяется (взаимодействует) с одним атомом или ионом водорода.
Из этого определения видно, что понятие «эквивалент» относится к конкретной химической реакции; если его относят к атому в химическом соединении, то имеют в виду реакцию образования этого соединения из соответствующего простого вещества и называют эквивалентом элемента в соединении.
В одном атоме, одной молекуле или формульной единице вещества (В) может содержаться Z эквивалентов этого вещества. Число Z называют эквивалентным числом (или показателем эквивалентности). Обратная величина этого числа называется фактором эквивалентности. Фактор эквивалентности (f) — доля частицы, составляющая эквивалент.
Относительная масса эквивалента называется эквивалентной массой, а масса одного моля эквивалентов, выраженная в граммах, называется молярной эквивалентной массой; она обозначается Мэк, единица измерения – моль эк/г, она численно равна относительной молекулярной массе эквивалента.
Пример 5. Определить эквивалент, эквивалентную массу и молярную массу эквивалента кислорода в молекуле воды.
Решение. Такая формулировка вопроса предполагает реакцию образования воды из кислорода и водорода H2 + ½O2 = Н2О, в которой с 1 атомом водорода соединяется ½ атомов кислорода. Следовательно, Z(О) = 2. Атомная масса кислорода равна 16. Эквивалентом кислорода является ½ его атома, эквивалентная масса равна 8, а молярная масса эквивалента равна 8 г/ моль.
Эквиваленты одних и тех же элементов в различных химических соединениях могут различаться, т.к. величина эквивалента зависит от характера превращения, претерпеваемого им. Так, в соединении SO2 эквивалентная масса серы равна 8 г/моль, что составляет 1 /4 от атомной массы, а в соединении SO3 — 5,3 г/моль, что составляет 1 /6 от атомной массы серы.
Эквивалентное число серы в этих оксидах равно 4 и 6, т.е. оно равно степени окисления (стехиометрической валентности) серы в этих соединениях. Таким образом, относительная эквивалентная масса и численно равная ей молярная масса элемента в соединении вычисляется по формуле:
Мэк (элемента) = 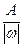 , (1.7)
, (1.7)
где А — атомная масса, w — степень окисления элемента в данном соединении.
Например, Z(Mn) в соединении KMnO4 составляет 7(w = +7), а Мэк (Mn)=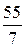 = 7,85 г/моль; в соединении Mn2O3 Z = 3 и поэтому Мэк (Mn)=
= 7,85 г/моль; в соединении Mn2O3 Z = 3 и поэтому Мэк (Mn)=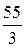 = 18,3 г/моль.
= 18,3 г/моль.
Эквивалентная масса вещества имеет различные значения в зависимости от того, в какой химической реакции участвует это вещество. При расчете эквивалентных масс можно пользоваться следующими правилами и формулами.
1. Эквивалентная масса кислоты в реакциях замещения ионов водорода равна:
Мэк кислоты = 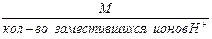
2. Эквивалентная масса основания в реакции замещения гидроксид-ионов равна:
Мэк основания = 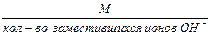
Пример 6. Определить эквивалентную массу H2SO4 в реакциях:
Решение. В реакции 1 замещён один ион водорода, следовательно, эквивалентное число серной кислоты Z(H2SO4) = 1, Мэк(H2SO4) = 98 г/моль эк. В реакции 2 заместились оба иона водорода, следовательно, эквивалентное число Z(H2SO4) = 2, а Mэк(H2SO4) = 49 г/моль эк.
Пример 7. Определить эквивалентную массу гидроксида висмута в реакциях:
Решение. 1) Z(Bi(OH)3) = 1, а Mэк(Bi(OH)3) = 260 г/моль эк, т.к. из трех гидроксид-ионов заместился один; 2) Z(Bi(OH)3) = 3, a Mэк(Bi(OH)3) = 260 : 3 = 86,3 г/моль эк, т.к. заместились все три иона ОН — ).
3. Эквивалентная масса соли в реакциях полного замещения катиона или аниона равна:
Мэк. соли = 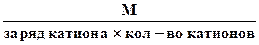
или Мэк соли = 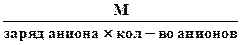
Например. в сульфате алюминия Al2(SO4)3 произведение заряда катиона на их число равно 3×2 = 6. Но эквивалентное число соединения в реакции может быть меньше (неполное замещение катионов) или больше (комплексообразование). Если, например, это соединение участвует во взаимодействии Al2(SO4)3 + 12KOH = 2K3[Al(OH)6] + 3K2SO4, то при этом три сульфат-аниона с суммарным зарядом 6 замещаются двенадцатью гидроксид-ионами ОН — , следовательно, в этой реакции Z(Al2(SO4)3) = 12.
4. Эквивалентная масса оксида в реакциях полного замещения равна
Мэк оксида = 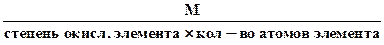
Например, Z(Fe2O3) = 3 × 2 = 6, Мэк = М(Fe2O3) = 160 : 6 = 26,6 г/моль эк. Но в реакции
Z(Fe2O3) = 4, Мэк(Fe2O3) = 160 : 4 = 40 г/моль эк, т.к. одна формульная единица Fe2O3 взаимодействует с четырьмя эквивалентами HCl.
При решении задач, связанных с газообразными веществами, целесообразно пользоваться значением эквивалентного объема. Это объем, занимаемый одним молем эквивалентов газообразного вещества. Для водорода при н.у. этот объем равен 11,2 л/моль эк (так как Мэк(Н) = 1 г/моль эк), а для кислорода – 5,6 л/моль эк (так как Мэк(О) = 8 г/моль эк).
Пример 8. На восстановление 1,80 г оксида металла израсходовано 883 мл водорода (н.у.). Вычислить эквивалентные массы оксида и металла.
Решение. Согласно закону эквивалентов, массы (объемы) реагирующих веществ пропорциональны их эквивалентным массам (объемам):
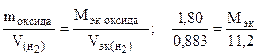
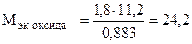 (г/моль),
(г/моль), 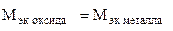 +
+ 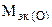 ,
,
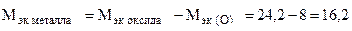 г/моль эк.
г/моль эк.
Пример 9. Вычислить эквивалентную массу цинка, если 1,168 г этого металла вытеснили из кислоты 438 мл Н2 (Т = 17 °С и Р = 750 мм рт. ст.).
Решение. 1) По уравнению Клапейрона–Менделеева вычисляем массу водорода:
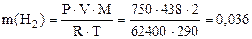 г
г
Согласно закону эквивалентов
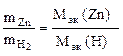 ,
,
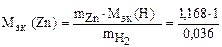 = 32,6 г/моль эк.
= 32,6 г/моль эк.
Не нашли то, что искали? Воспользуйтесь поиском:
Лучшие изречения: Да какие ж вы математики, если запаролиться нормально не можете. 8452 —  | 7341 —
| 7341 —  или читать все.
или читать все.
78.85.5.224 © studopedia.ru Не является автором материалов, которые размещены. Но предоставляет возможность бесплатного использования. Есть нарушение авторского права? Напишите нам | Обратная связь.
Отключите adBlock!
и обновите страницу (F5)
очень нужно
Ответ
Не тот ответ, который тебе нужен?
Что ты хочешь узнать?
Самые новые вопросы

- leocatsu
- Химия
- silinaola
- Химия
- silinaola
- Химия

- skvorgrand
- Химия
- 8van
- Химия
- асет31
- Химия
- khavanoao
- Химия
- асет31
- Химия
3,5 г) высыпаемв колбу с водой.3. Перемешиваем стеклянной палочкой до полного растворения. Полу-чаем подслащенный водный раствор.Отмерьтемерным цилиндром50 мл воды.Влейте водув коническуюколбу.Рис. 59. Приготовление растворасть 2. Произведение расчетов1. Рассчитываемссовую долю сахара в растворе. Например:объем воды в колбе = 50 мл;масса сахара — 3,5 г.
