Здесь легко и интересно общаться. Присоединяйся!
патамушта изотерма это при постоянной температуре а если газ расширяется значит он охлаждается а если изотерма то значит газ нагревается от стенок поэтому и не так круто спадает
давление идеального газа P
T/V и может уменьшаться или за счет роста объема или за счет понижения температуры. в изотермическом процессе действует только первая причина, а в адиабатическом обе одновременно, поэтому в нем давление падает круче.
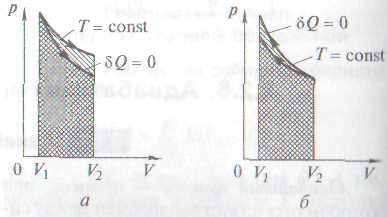 |
В адиабатном ( 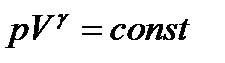 ) и изотермическом (pV = const) процессах наблюдаются существенные различия в характере изменения давления при расширении (рис. а) и сжатии (рис. б). Поскольку ɣ>1, адиабата идет круче, чем изотерма. Это можно объяснить тем, что при адиабатном сжатии газ нагревается (увеличение р обусловлено не только уменьшением V(как при изотермическом процессе), но и повышением температуры). При адиабатном расширении газ охлаждается (уменьшение р обусловлено не только увеличением V (как при изотермическом процессе), но и уменьшением температуры).
) и изотермическом (pV = const) процессах наблюдаются существенные различия в характере изменения давления при расширении (рис. а) и сжатии (рис. б). Поскольку ɣ>1, адиабата идет круче, чем изотерма. Это можно объяснить тем, что при адиабатном сжатии газ нагревается (увеличение р обусловлено не только уменьшением V(как при изотермическом процессе), но и повышением температуры). При адиабатном расширении газ охлаждается (уменьшение р обусловлено не только увеличением V (как при изотермическом процессе), но и уменьшением температуры).
Работа газа в адиабатном процессе
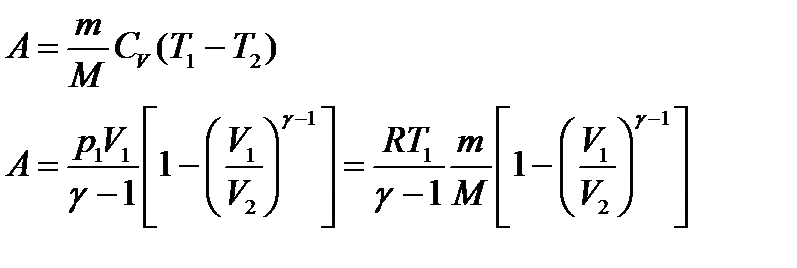
Политропный процесс
Политропный процесс – процесс, в котором теплоемкость остается постоянной.
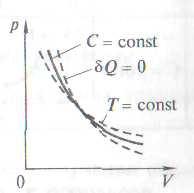
Уравнение и график политропного процесса 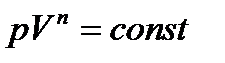
Политропа – график (гипербола) зависимости между параметрами
Состояния C = const.(n – показатель политропы, 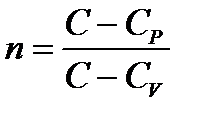 )
)
 |
Частные случаи политропного процесса
| С=0 | n=γ | pV γ =const | Уравнение адиабаты |
C= 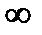 |
n=1 | pV=const | Уравнение изотермы |
| C=Cp | n=0 | р=const | Уравнение изобары |
| C=CV | n=± 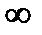 |
V=const | Уравнение изохоры |
Дата добавления: 2016-12-16 ; просмотров: 8736 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Первое начало термодинамики
Это условие на практике неосуществимо. Оно выполняется только для быстро протекающих процессов.
Адиабатный процесс
Адиабатный и политропный процессы
Теплота
Внутренняя энергия
Все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил.
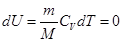
При Т=const внутренняя энергия идеального газа не изменяется.

Адиабатный процесс – процесс, при котором отсутствует теплообмен между системой и окружающей средой.



В случае адиабатного процесса система совершает работу за счет убыли внутренней энергии системы.
Уравнение адиабатного процесса (уравнение Пуассона)

Уравнения адиабатного процесса в переменных Т, V и р, Т

Показатель адиабаты (показатель Пуассона)

Для одноатомных газов i =3, ɣ = 1,67; для двухатомных – i = 5; ɣ = 1,4.
i – число степеней свободы;  — соответственно молярные и удельные теплоемкости при постоянных давлении и объеме.
— соответственно молярные и удельные теплоемкости при постоянных давлении и объеме.
Адиабата – в координатах p,V – это гипербола.
 |
В адиабатном (  ) и изотермическом (pV = const) процессах наблюдаются существенные различия в характере изменения давления при расширении (рис. а) и сжатии (рис. б). Поскольку ɣ>1, адиабата идет круче, чем изотерма. Это можно объяснить тем, что при адиабатном сжатии газ нагревается (увеличение р обусловлено не только уменьшением V (как при изотермическом процессе), но и повышением температуры). При адиабатном расширении газ охлаждается (уменьшение р обусловлено не только увеличением V (как при изотермическом процессе), но и уменьшением температуры).
) и изотермическом (pV = const) процессах наблюдаются существенные различия в характере изменения давления при расширении (рис. а) и сжатии (рис. б). Поскольку ɣ>1, адиабата идет круче, чем изотерма. Это можно объяснить тем, что при адиабатном сжатии газ нагревается (увеличение р обусловлено не только уменьшением V (как при изотермическом процессе), но и повышением температуры). При адиабатном расширении газ охлаждается (уменьшение р обусловлено не только увеличением V (как при изотермическом процессе), но и уменьшением температуры).
Дата добавления: 2017-01-14 ; Просмотров: 1235 ; Нарушение авторских прав? ;
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
