Содержание
Зная величины констант равновесия и используя стехиометрические соотношения реакции (закон сохранения массы), рассчитывают равновесный состав продуктов по следующей схеме.
Пишут уравнение реакции.
2. Пишут под формулами уравнения начальные концентрации исходных веществ (в моль/л). Если начальные концентрации продуктов реакции не оговариваются в условии задачи, они обычно принимаются равными нулю.
3. Принимают, что в ходе реакции до состояния равновесия прореагировало x моль/л какого-либо вещества. Обычно за x принимают изменение концентрации того реагента, стехиометрический коэффициент при котором в уравнении реакции наименьший, чтобы избежать дробных коэффициентов при неизвестном x. Например, прореагировало x моль/л вещества А.
4. По уравнению реакции определяют изменение концентраций других веществ.
5. Определяют равновесные концентрации веществ. При протекании реакции в прямом направлении до состояния равновесия происходит уменьшение концентраций исходных веществ и увеличение концентраций продуктов реакции.
по уравнению 1 b c 1
6. Пишут выражение закона действующих масс. Подставляют в него найденные значения равновесных концентраций.
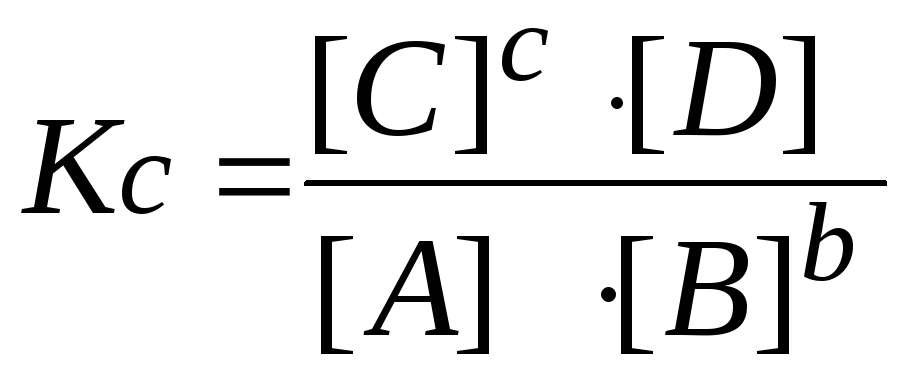 ,
,
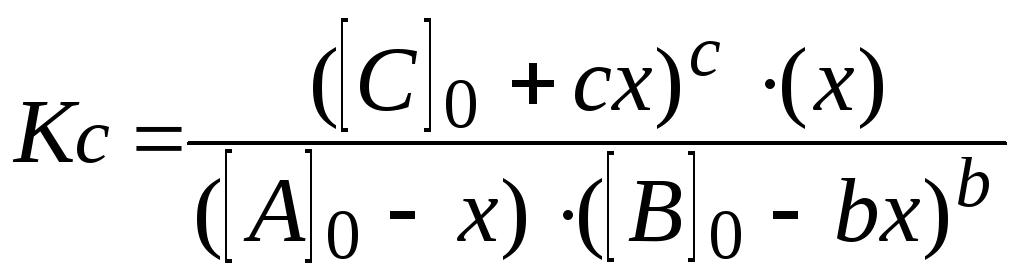
7. Решают уравнение. При этом учитывают, что отрицательный корень не имеет физического смысла, и убыль концентрации исходного вещества не может быть больше величины самой концентрации (начальная концентрация исходного вещества не может быть меньше его остаточной равновесной концентрации).
Находят равновесные концентрации.
4. Смещение химического равновесия. Принцип Ле Шателье
Истинное химическое равновесие является динамическим и подвижным: изменение внешних условий (температуры, давления, концентраций реагирующих веществ) ведет к смещению равновесия в сторону прямой или обратной реакции.
Характер влияния внешних факторов на равновесные системы выражает принцип Ле Шателье.
Если на систему, находящуюся в состоянии равновесия, оказать внешнее воздействие, то смещение равновесия происходит в сторону той реакции (прямой или обратной), которая ослабляет эффект внешнего воздействия.
4.1. Изменение концентраций
Равновесное состояние в системе
характеризуется (для одной и той же температуры) константой равновесия:
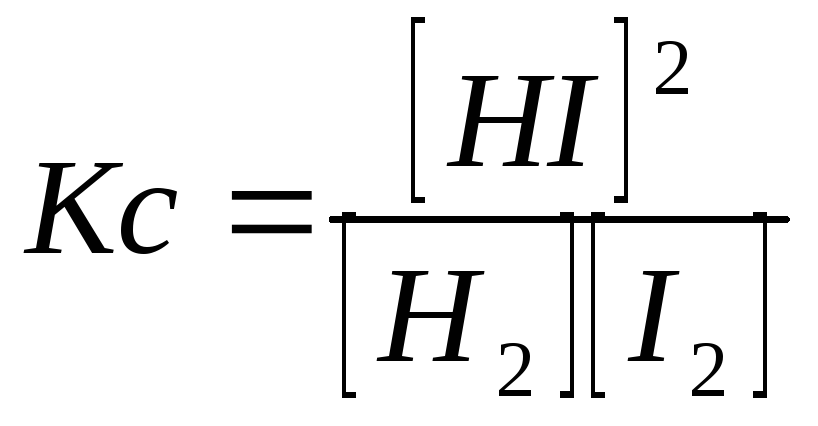 .
.
Если, например, в систему добавить водород, т.е. увеличить его концентрацию, то скорость прямой реакции увеличится (в соответствии с законом действующих масс):
 пр = kпр [H2] [I2],
пр = kпр [H2] [I2],  пр
пр  обр,
обр,
равновесие сместится вправо. Концентрация йодоводорода будет увеличиваться, а концентрация водорода и йода будет уменьшаться. Процесс будет протекать до тех пор, пока не установится новое равновесие. Новые равновесные концентрации всех компонентов будут другими, но соотношение между ними, определяемое константой равновесия, останется постоянным.
Если в систему ввести дополнительное количество йодоводорода, то скорость обратной реакции увеличится:
 обр = kобр [HI] 2 ,
обр = kобр [HI] 2 ,  обр
обр  пр ,
пр ,
равновесие сместится влево.
В соответствии с принципом Ле Шателье:
— при увеличении концентрации какого-либо из веществ, участвующих в равновесии, равновесие смещается в сторону расхода этого вещества;
— при уменьшении концентрации какого-либо из веществ равновесие смещается в сторону образования этого вещества.
Удаление из системы продуктов (или продукта) реакции ведет к смещению равновесия в сторону прямой реакции, а уменьшение концентрации исходных (или исходного) веществ, приводит к сдвигу равновесия в направлении обратной реакции.
Задачник по общей и неорганической химии
5. Химическое равновесие
5.1. Состояние химического равновесия
Теоретическая часть

характеризуется наступлением состояния истинного химического равновесия. В этом состоянии выполняется (по определению) условие неизменности во времени молярных концентраций реагентов и продуктов, называемых равновесными концентрациями.
В отличие от молярной концентрации некоторого вещества В (сВ) в любом неравновесном состоянии системы равновесная концентрация того же вещества обозначается квадратными скобками [В].
Для обратимой химической реакции, протекающей при некоторой температуре, устанавливаются любые, но постоянные равновесные концентрации [А], [В], [С], [D]. Они не зависят друг от друга, а определяются только положением состояния равновесия.
В соответствии с законом действующих масс состояние равновесной химической системы характеризуется константой равновесия:

Выражение (5.2) позволяет рассчитать KС по известным равновесным концентрациям всех веществ гомогенной газофазной реакции (5.1), а также для гомогенной реакции в растворе, например

или концентрацию одного из веществ по известным равновесным концентрациям остальных веществ и KС.
Пример 1. При некоторой температуре в системе

равновесные концентрации веществ равны соответственно 0,04, 0,12 и 0,06 моль/л. Рассчитать KС реакции.


Ответ. Для данной реакции KС = 0,54.
Если по условию задачи известна равновесная концентрация только одного продукта из нескольких, то перед расчетом KС необходимо вычислить незаданные равновесные концентрации продуктов по выражению

Пример 2. При некоторой температуре в системе

равновесные концентрации С2Н6, О2 и СО2 составили соответственно 0,22, 1,34 и 0,57 моль/л. Рассчитать KС реакции.

Ответ. Для данной реакции KС = 0,11.
Для гетерогенных реакций, в которых при данной температуре среди реагентов и продуктов присутствуют (помимо газов) отдельные фазы твердых и жидких веществ, равновесные концентрации твердых и жидких веществ в выражение для константы равновесия не входят ввиду их постоянства во всей области существования данных агрегатных состояний этих веществ.
Действительно, равновесная концентрация некоторого жидкого вещества В или твердого вещества С есть отношение их плотности (ρВ или ρС) к молярной массе (МВ или МС):

поэтому концентрации В(ж) и С(т) постоянны и не зависят от присутствующего количества этих веществ в реакции.
Для некоторой гетерогенной обратимой реакции

выражение для константы равновесия имеет вид

Состояние истинного равновесия в химической системе (5.1) называют также динамическим, поскольку в ней протекает двусторонняя реакция в прямом направлении (А и В — реагенты, С и D — продукты) и обратном (А и В — продукты, С и D — реагенты). Кроме того, подход к состоянию равновесия при некоторой температуре может осуществляться как в прямом, так и в обратном направлении (рис. 5.1, поля 1 и 2). При этом кривые зависимости соотношения неравновесных концентраций веществ (составлено аналогично выражению 5.2) от времени сходятся в точке, отвечающей (по оси абсцисс) значению KС для данной реакции.
В реакции (5.1), протекающей в прямом направлении, значения [С] и [D] будут максимальными концентрациями продуктов, а [A] и [В] минимальными остаточными концентрациями реагентов. Следовательно, KС фактически определяет равновесный (максимально возможный в данных условиях) выход каждого продукта.

Равновесный выход продукта отношение количества продукта в состоянии равновесия обратимой реакции (nравн) к стехиометрическому количеству этого продукта в той же, но необратимой реакции (nстех) или отношение соответствующих концентраций. Так, для реакции (5.1) имеем:

Если значение KС велико, то произведение [С] с x [D] d много больше произведения [A] a x [B] b , т. е. в системе преобладает прямое направление реакции и равновесные концентрации продуктов намного больше, чем равновесные концентрации реагентов, а потому выход продуктов С и D велик.
Аналогично при очень малом значении KС преобладает обратное направление реакции и выход продуктов С и D прямой реакции незначителен.
При KС = 1 преобладание прямого и обратного направления реакции отсутствует.
Если сложная химическая реакция осуществляется в два или большее число этапов, для которых известны значения KС, то константу равновесия этого процесса можно выразить через KС этапов, например (все вещества — газы):

В расчетных задачах этого раздела предполагается, что подход к состоянию равновесия обратимой реакции осуществляется за счет ее прямого направления. В начальный момент реакции, протекающей по реакции (5.1), концентрации газообразных реагентов имеют некоторые (любые заданные) значения с0А и с0В, а концентрации газообразных продуктов равны нулю (с0С = с0D = 0).
Если в реакции участвуют жидкие и твердые вещества, то считается, что они полностью нелетучи и потому не имеют никакой концентрации в газовой фазе.
При протекании реакции в прямом направлении до состояния равновесия происходит уменьшение концентраций газообразных реагентов и увеличение концентраций газообразных продуктов, определяемые по закону сохранения выражениями:

Эти выражения позволяют рассчитать равновесные концентрации веществ по начальным концентрациям реагентов при известном значении KС (и наоборот).
Пример 3. При некоторой температуре в системе

равновесная концентрация О2 составила 0,2 моль/л. Определите начальную концентрацию реагента.


Ответ. Начальная концентрация NO2 была равна 0,45 моль л.
Выражение для [NO2] выведено и подставлено в расчетную формулу из закона действующих масс (5.2):

Пример 4. При Т = const рассчитайте равновесные концентрации газообразных веществ в системе

если начальная концентрация СО составляла 0,16 моль л.



Ответ. Равновесные концентрации СO и СO2 равны соответственно 0,1 и 0,06 моль л.
Указанную систему уравнений можно было решить и относительно [СO2], а затем вычислить значение [СO]:


Пример 5. При Т = const рассчитайте равновесные концентрации реагента и продуктов в системе

если начальное количество PCl5 было 6 моль, а объем реактора составляет 5 л.


отсюда

Решая квадратное уравнение, получаем: [Cl2]1 = + 0,2 моль/л (реальный корень); [Cl2]2 = 0,24 моль/л (нереальный корень);

Ответ. Равновесные концентрации Cl2, PCl5 и PCl3 составляют 0,2, 1,0 и 0,2 моль л соответственно.
Обратите внимание на то, что один из корней квадратного уравнения всегда будет нереальным, т.е. его значение будет либо отрицательным (а такие значения концентраций не имеют химического смысла), либо положительным, но дающим для реагента неравенство [ ] > с (а начальная концентрация реагента, по определению, не может быть меньше его остаточной равновесной концентрации). В этом примере значение нереального корня отрицательное.
В системе A(г)+2В(г)С(г) равновесие концентрации равны:
[A]=0,6 моль/л, [В]=1,2 моль/л, [С]=2,16 моль/л.
Найдите константу равновесия реакции и исходные концентрации веществ А и В.
Из уравнения видны, что 1 моль вещества А образует 1 моль вещества С, значит 2,16 моля образуется на 2,16 моль А.
